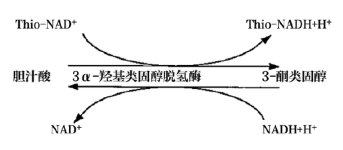
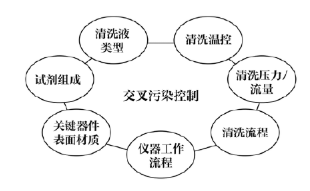
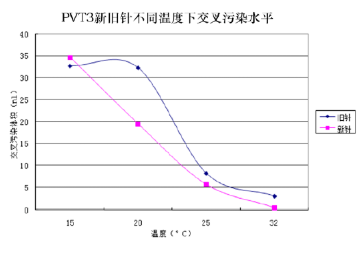
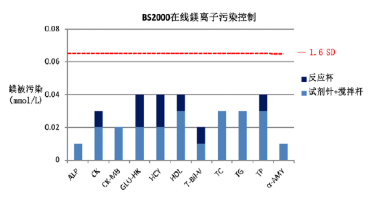
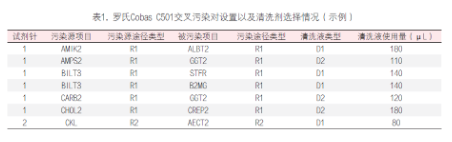
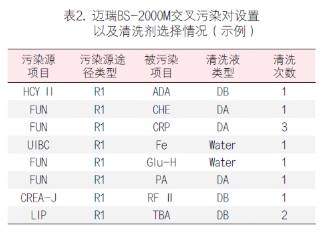
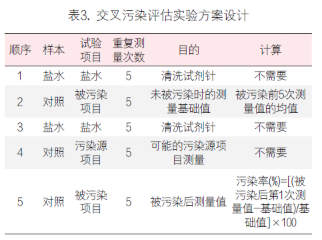
一 攜帶污染的定義 攜帶污染(carry-over 或 carryover)是指由測量系統(tǒng)將一個檢測樣品反應(yīng)攜帶到另一個檢測樣品反應(yīng)的分析物不連續(xù)量,,由此錯誤地影響了另一個檢測樣品的表現(xiàn)量,。某一生化檢測從加樣開始至反應(yīng)結(jié)束、清洗完成的任意過程中殘留的任一物質(zhì)(可以為生物樣本,,也可以為試劑或混合反應(yīng)液)通過儀器硬件(包括但不限于試劑針,、樣品針、反應(yīng)杯,、攪拌桿,、管路等)被攜帶到下一個生化檢測反應(yīng)中,參與反應(yīng)和/或影響反應(yīng)進程,,并導(dǎo)致檢測結(jié)果顯著偏差的過程,。生化分析儀的攜帶污染不可能完全避免,只有當這些反應(yīng)殘留物對下一個反應(yīng)結(jié)果的影響非常顯著,,超過實驗室預(yù)設(shè)的分析質(zhì)量標準或影響患者臨床結(jié)局時,才被定義為攜帶污染,,需要采取必要的措施。當這樣的攜帶污染發(fā)生在兩個特定的檢測項目(試劑)之間時,,也被稱交叉污染(cross contamination)。 二 攜帶污染的來源 1.試劑成分間的直接影響:前一個測定試劑中直接含有后一個測試試劑所要測定的項目, 例如:AMY的試劑1(R1)試劑中含有Ca離子(酶活化劑),,當某樣品檢測AMY和Ca項目時,順序是先AMY,,后測Ca,。因吸取過AMY的R1試劑針上可能沾有殘留的R1試劑,當R1試劑針再吸取Ca試劑時,,會引入AMY的R1試劑中含有的Ca離子,這樣對Ca項目的檢測結(jié)果可能造成正誤差,。常見試劑成分間的直接影響有:(1)GLU(氧化酶法),、TP與ACP試劑中含有較高濃度的鉀(K+ );(2)ChE,、CHOL,、GLU(GOD法)、UA(尿酸酶法),、LD(IFCC法),、HBDH(DGKC法)等試劑中含有磷酸鹽緩沖液;(3)CHOL,、TG試劑及HDL-C試劑中含有膽酸鈉,;(4)ALT(IFCC法)、(AST)(IFCC法)試劑中含有高活性的LD,。以上試劑的成分分別會對K+(紫外酶法),、磷(P)、總膽汁酸(TBA)及LD的測定結(jié)果形成干擾,,造成交叉污染,。 2.試劑成分間的間接影響:試劑成分參與反應(yīng),上一個試劑中含有的某種試劑成分與下一反應(yīng)所要測定的底物相互作用,因而干擾下一反應(yīng)的測定結(jié)果,。例如:Mg2+測定試劑的絡(luò)合劑也能與鐵(Fe)結(jié)合,,影響鐵與鐵絡(luò)合劑的結(jié)合;直接膽紅素(D-Bil)重氮法試劑與Mg2+試劑中含有EDTA,,均能與Ca結(jié)合,,從而影響Ca的測定;以甘油作為酶保護劑的試劑,,會對TG的測定帶來干擾,;鈣(MTB法)試劑對K+有負干擾,;CHOL試劑中含有膽固醇酯酶,,可水解膽固醇酯形成游離膽固醇,對游離膽固醇測定造成干擾,。 3.反應(yīng)產(chǎn)物的影響:上一個試劑所引導(dǎo)的反應(yīng)對下一個項目的反應(yīng)進程帶來間接的干擾,,下一項目所測定的是前后兩個項目反應(yīng)的綜合作用結(jié)果。當上一反應(yīng)產(chǎn)物為H2O2時,,則對以Trinder反應(yīng)產(chǎn)生顏色的測定結(jié)果造成干擾,,如UA對CHOL結(jié)果的影響,CHOL對CREA(酶法)測定結(jié)果的影響,,GLU(氧化酶法)對CREA測定結(jié)果的影響,。CK(NAC法)、CK-MB(NAC法)試劑中含有GLU成分,,其分析方法的原理中包含GLU的己糖激酶(HK)反應(yīng)過程,,因此可能對GLU的測定帶來干擾,尤其對GLU的HK法測定可能帶來嚴重干擾,。 4.影響反應(yīng)條件:上一試劑緩沖液成分改變了下一反應(yīng)的pH環(huán)境,,從而改變反應(yīng)速率。例如:TP(雙縮脲法)測定需在pH8~9時,,蛋白肽鍵才都能與堿性銅溶液作用生成紫色反應(yīng),,若pH<8,則會導(dǎo)致TP結(jié)果偏低,,還直接影響球蛋白,、白蛋白/ 球蛋白結(jié)果;酶活性測定有最適pH,,大多數(shù)酶反應(yīng)pH在6.0~7.5之間,,ALP、GGT,、LDH則在堿性條件下最適宜,;CREA(苦味酸速率法)反應(yīng)條件為堿性,,果糖胺(動力學(xué)法)反應(yīng)條件為酸性,受到污染后反應(yīng)速率會減慢,。CREA(酶法)試劑中含有抗壞血酸氧化酶,,影響了氧化還原反應(yīng)的進程,會對TBA(酶循環(huán)法)測定結(jié)果有影響,;D-Bil(釩酸鹽氧化法)試劑中的酒石酸鹽緩沖液會影響ALT活性,,對測定結(jié)果有負干擾。 三 攜帶污染的途徑 1.試劑針污染:一般高速全自動生化分析儀都采用雙試劑針,,即所有項目的第一試劑都共用試劑針R1,,所有項目的第二試劑都共用試劑針R2。試劑針R1或R2在每吸取一次試劑后都會進行一次清洗,,之后會立即吸取下一個項目的試劑,。如果儀器清洗能力下降或沒有定期進行維護,試劑針在吸取試劑時會將部分殘留的前一項目試劑成分帶入到后一項目反應(yīng)杯中,,對后一項目檢測結(jié)果造成影響,。從各個項目設(shè)置的參數(shù)可知,試劑體積量遠大于樣本體積量,,因此試劑針攜帶污染影響程度會高于樣本針攜帶污染,。 2.攪拌棒污染:試劑與樣本、第一試劑與第二試劑的混勻需要攪拌棒,,而攪拌棒如果清洗不完全或黏附力增加時,,殘留試劑可能會對下一檢測結(jié)果造成影響。 3.比色杯污染:生化分析儀的比色杯大體分為兩種,,一種是循環(huán)使用的(如石英比色杯等),,另一種是需要定期更換的(如塑料比色杯等),每個比色杯檢測完畢后,,進行自動清洗,然后繼續(xù)下一個檢測項目的檢測,。當由于各種原因?qū)е履硞€比色杯清洗不完全或該比色杯老化時,,吸附在比色杯上的上一個項目的殘留試劑或者反應(yīng)物可能會對在這個比色杯中進行的下一個項目的檢測結(jié)果造成影響。根據(jù)經(jīng)驗,,比色杯的污染對結(jié)果影響最大,,因為比色杯最難以清洗干凈,且在實際工作中難以判斷在該比色杯中檢測的前后測試項目,?!?/p> 4.樣本針污染:目前大多數(shù)全自動生化分析儀采用注射器或定量泵產(chǎn)生負壓,通過樣本針吸取樣本,,吸樣后通過一定壓力的清洗水清潔樣本針,。當樣本針在清洗不完全或黏附力增加時,樣本殘留可能會對下一相鄰樣本的檢測結(jié)果造成影響。 5.清洗系統(tǒng):目前大多數(shù)全自動生化分析儀采用多階清洗劑和清洗水清潔比色杯,,當清洗針或干燥針上有試劑,、樣本或反應(yīng)物殘留,可能會對下一個被清洗比色杯的測定結(jié)果造成影響,,一般來說清洗系統(tǒng)帶來的攜帶污染很少,,可以忽略。 四 配套檢測系統(tǒng)解決攜帶污染之道 1.從機理上盡可能去除污染之源:TC試劑配方中一般含有一種物料(具有提高試劑穩(wěn)定性和抗脂血干擾的作用)是TBA的檢測底物,;而TBA是循環(huán)酶法試劑,,可將底物信號循環(huán)放大(圖1),因此只要有微量的底物殘留,,就會對結(jié)果產(chǎn)生很大影響,,并且從反應(yīng)曲線上無法看出是否存在污染。深圳邁瑞公司的TC項目試劑盒,,通過優(yōu)化配方,,從根本上解決了交叉污染問題。 圖1 TBA檢測原理示意圖 2.提高儀器清洗能力阻斷污染之路:從儀器系統(tǒng)設(shè)計到關(guān)鍵器部件設(shè)計再到清洗時序設(shè)計,,步步精細化控制交叉污染,,如圖2。不同清洗水溫度對試劑針攜帶污染的影響不同,,隨著清洗水溫度增高,,攜帶污染物殘留體積會降低,且對新舊試劑針的影響程度不同,。 圖2 生化分析系統(tǒng)清洗流程 圖3 清洗水溫度對新舊試劑針攜帶污染的影響 3.完整的項目全遍歷交叉污染評估:在構(gòu)建封閉檢測系統(tǒng)時,,要對所有開展的項目進行全遍歷交叉污染篩查,在理論分析的指導(dǎo)下,,使用添加法做覆蓋性篩選,,再全遍歷實測,一般取偏差<5%,,或<1.6SD作為指標,,也可以參考臨床指標。這是一項系統(tǒng)性的工作,,通常在新檢測系統(tǒng)構(gòu)建,、增加新試劑、儀器試劑變更等情況下進行,。 交叉污染評估中SD的含義與指標定義:評價項目間的交叉污染時,,評估被污染項目的濃度一般取該項目的醫(yī)學(xué)決定水平點濃度中的最低濃度點左右的值作為測試濃度(譬如:ALT醫(yī)學(xué)決定水平點為20U/L、60U/L,、300U/L,,那么評估交叉污染選取樣本濃度為20U/L左右),,污染源項目則取該項目的線性上限濃度值。評估項目交叉污染時的SD選取被污染項目基準濃度的批內(nèi)精密度SD(譬如,,ALT為被污染項目,,那么20U/L左右的濃度值測量10次或20次,計算SD),,指標取1.6SD,。因Westgard質(zhì)控規(guī)則一般取2SD作為評判結(jié)果是否失控的警告限或離群標準,選取2SD的80%作為評估標準,,即當被污染結(jié)果小于1.6SD,,認為結(jié)果與正確值無顯著偏差;我們?nèi)∑钚∮?%或小于1.6SD,,這個指標是比較嚴格的,,一般評估交叉污染的文獻上取10%作為可接受指標[1]。 生化分析系統(tǒng)中其他試劑對鎂離子檢測的攜帶污染較難控制,。各品牌生化儀為降低攜帶污染對鎂離子測定的影響,,設(shè)計了多種控制方法。例如:羅氏 COBAS c701 設(shè)有12組鎂離子試劑針污染對,,貝克曼同時設(shè)有試劑針和攪拌桿的鎂離子污染對, 邁瑞B(yǎng)S-2000M機型通過提升儀器清洗試劑針,、攪拌桿和反應(yīng)杯的能力,將試劑針,、攪拌桿和反應(yīng)杯對鎂離子的總系統(tǒng)污染率控制在0.04mmol/L以下,,見圖4。 圖4 BS2000生化分析系統(tǒng)鎂被污染的評估 4.儀器防交叉污染功能設(shè)計與測試流程優(yōu)化:儀器強大的防交叉污染功能可以有效避免項目間交叉污染的發(fā)生,。在同一樣本內(nèi),,測試項目根據(jù)項目間污染的情況優(yōu)化測試順序;在不同樣本間,,則可通過設(shè)置強化清洗,,并且根據(jù)項目污染的特性,智能選擇酸,、堿或去離子水作為清洗劑,。羅氏交叉污染對設(shè)置以及清洗劑選擇情況見表1,邁瑞B(yǎng)S-2000M交叉污染對設(shè)置以及清洗劑選擇情況見表2,。 五 自建檢測系統(tǒng)攜帶污分析策略 1.自建檢測系統(tǒng)所面臨的攜帶污染問題:自建系統(tǒng)所用試劑來源于不同廠家,試劑污染源成份復(fù)雜,,通過試劑說明書很難判定試劑項目間是否存在污染,,往往只能靠經(jīng)驗以及樣本檢測過程中的結(jié)果異常去發(fā)現(xiàn)項目間交叉污染并進行規(guī)避設(shè)置。檢測系統(tǒng)投入使用前,,完整地去遍歷所有開展項目間的交叉污染,,工作量大,,而且往往需要檢驗人員對儀器的工作流程十分了解。使用過程中增,、減項目,,又會改變項目的測試順序,也有可能帶來新的交叉污染,。 2.自建檢測系統(tǒng)攜帶污分析策略:根據(jù)生化分析儀攜帶污染的分析評估及處理方法專家共識[2]試劑攜帶污染分析思路如下:收集現(xiàn)有的項目交叉污染的資料,,包括但不限于制造商手冊、制造商通告,、文獻等,,尋找被污染項目可能受哪些項目的試劑污染;研究被污染項目所在的檢測單元的試劑分布,、檢測程序,,是否存在已知的“配對”交叉污染;分析被污染項目使用相同試劑針,、攪拌桿,、沖洗頭、比色杯等儀器原件,,緊鄰的前一個項目是何項目,,分析是否存在污染的可能;如已有的資料信息和結(jié)果信息無法提示到底被哪一個項目的試劑污染,,則可以設(shè)計試驗評估與被污染項目處于相同檢測單元中的所有其他項目試劑是否發(fā)生攜帶污染,。 3.自建檢測系統(tǒng)交叉污染評價方案:以雅培公司Abbott Architect c8000臨床生化分析儀對32個生化項目的交叉污染評估為例[3],實驗方案設(shè)計見表3,。實驗室結(jié)果顯示以下項目配對之間不存在交叉污染:糖-鐵,鐵-糖,;血紅蛋白-ALT,ALT-血紅蛋白;膽堿酯酶-Urea,,Urea-膽堿酯酶,;C4-肌酐,肌酐-C4,;鋰-膽固醇,,膽固醇-鋰;鐵-血紅蛋白,,血紅蛋白-鐵,。以下項目配對之間存在交叉污染(攜帶污染率%):鐵蛋白-堿性磷酸酶(-10.7%),鐵蛋白-CK(-10.5%),鐵蛋白-鐵(-10.7%),,CRP-IgM(-15.8%),,膽堿脂酶-總膽紅素(+15.4%),乳酸-鐵蛋白(-22.9%),,尿素-鐵(-10.8%),,HDL-二氧化碳(-7.2%),,IgA-二氧化碳(-35.4%)。實驗室通過設(shè)置額外的水,、酸或者堿清洗后,,試劑間的交叉污染滿足要求。 六 交叉污染案例分析 某患者曾出現(xiàn)左腳大腳趾關(guān)節(jié)紅腫及劇烈疼痛,,懷疑是痛風(fēng)的表現(xiàn),,隨即到醫(yī)院檢查。與導(dǎo)醫(yī)溝通后,,得知自己的癥狀可能是痛風(fēng)也可能是風(fēng)濕免疫系統(tǒng)疾病,。在腎內(nèi)科就診后,心存疑慮的患者又就診于風(fēng)濕免疫科,,醫(yī)院當時未開通一卡通,,因此患者就拿著兩個科室主診醫(yī)生開具的兩份檢測申請又分別在兩個不同的采血窗口進行了采血登記,于是同一病人同時就有了兩份檢測結(jié)果,,樣本1尿酸(UA) 647μmol/L,,樣本2 UA 299μmol/L,兩份樣本結(jié)果差距巨大,,于是實驗室對兩個不同的測試結(jié)果進行驗證,。(1)重測兩份樣本,樣本1重測結(jié)果644μmol/L ,,樣本2重測結(jié)果升高至660μmol/L,;(2)樣本2(UA 299μmol/L)在科室另外一臺儀器上重測,結(jié)果652μmol/L,;(3)重測部分其他病人UA樣本,,重測結(jié)果與第一次測試結(jié)果沒有明顯偏差。實驗室判斷樣本2 第一次測試結(jié)果不正確,。實驗室查看兩個樣本的反應(yīng)曲線,,發(fā)現(xiàn)樣本2反應(yīng)監(jiān)測點13點后出現(xiàn)了一個明顯的負向反應(yīng),樣本1沒有,,顯然這個反應(yīng)受到了干擾,。檢查試劑、質(zhì)控結(jié)果均正常,,其他樣本測試結(jié)果正常,,因此懷疑在檢測過程中發(fā)生了攜帶污染。 引起攜帶污染的原因可能為攪拌棒,、試劑針,、比色杯以及樣本針等殘留前一個項目的物質(zhì),對下一個測試項目造成了干擾。首先懷疑試劑針的攜帶污染,,查閱儀器檢測記錄,可見受干擾的UA測試前進行了LDL-C及CHE測試,。實驗室的生化分析儀有兩個測試單元,,LDL-C測試被安排在2號測試單元,而UA和CHE同在1號測試單元,,可見測試單元1發(fā)生了CHE對UA的交叉污染,。實驗室進一步做了交叉污染確認試驗驗證,隨機選擇了兩個測試樣本,,每個樣本分成4管,,兩個樣本的測試設(shè)置均為先進行一個CHE測試,再按管1~4進行四個尿酸測試,,結(jié)果見表4 ,。驗證結(jié)果顯示CHE對尿酸檢測存在明顯的負干擾 。實驗室將UA和CHE兩個項目分開放置,,一個放置于內(nèi)圈,,一個放置于外圈,使用不同的試劑針加樣,,有效避免了兩個項目之間的交叉污染,。 七 小結(jié)